Problema nº 2 de estequiometría de las disoluciones, formalidad y masa - TP07
Enunciado del ejercicio nº 2
Al valorar una disolución de nitrato de plata se observó que se necesitaban 40 ml para precipitar todo el ion cloruro contenido es 36 ml de cloruro de sodio 0,52 F. ¿Qué masa de plata pueden obtenerse de 100 ml de la disolución de nitrato de plata?
Desarrollo
Datos:
V₁ = 40 ml
V₂ = 36 ml
F₂ = 0,52 N
mAg = 107,87 g
Fórmulas:
![]()
Solución
La neutralización del nitrato de plata con cloruro de sodio se realiza mol a mol.
Calculamos el número de moles de la solución de NaCl (n):
![]()
n = F₂·litro de solución
Reemplazamos por los valores y calculamos:
n = 0,52 F·0,036 l
n = 0,01872 de NaCl
El número de moles de NaCl se neutraliza con la misma cantidad de moles de nitrato de plata, por tanto, la formularidad del AgNO₃ es:
![]()
Reemplazamos por los valores y calculamos:
![]()
F₁ = 0,468 F de AgNO₃
Es decir, 0,468 g de AgNO₃ en un litro de solución (sc).
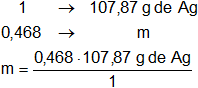
m = 50,48316 g de Ag
Esta masa se encuentra disuelta en un litro de solución, en 100 ml habrá:
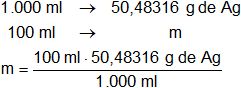
m = 5,048316 g de Ag
Resultado, la masa de plata que puede obtenerse de 100 ml de la disolución de nitrato de plata es:
m = 5,05 g de Ag
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular la masa de una sustancia en una valoración