Problema nº 4 de estequiometría de las disoluciones, masa y formalidad - TP09
Enunciado del ejercicio nº 4
¿Qué peso de (NH₄)₂SO₄ se necesita para preparar 400 ml de disolución ¼·F?
Desarrollo
Datos:
V = 400 ml
C = ¼·F
Solución
Calculamos el peso fórmula-gramo del sulfato de amonio:
(NH₄)₂SO₄: 2·(14,0067 g + 4·1,00797 g) + 32,064 g + 4·15,9994 g = 132,13876 g
Una disolución 1 F contiene 1 PFG de sulfato de amonio por litro de disolución, por tanto:
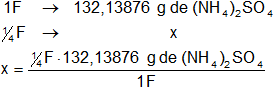
x = 33,03469 g de (NH₄)₂SO₄
Calculamos para 400 ml:
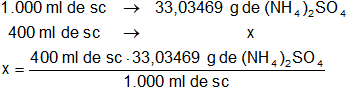
x = 13,213876 g de (NH₄)₂SO₄
Resultado, la masa de sulfato de amonio necesaria para preparar 400 ml de disolución ¼·F es:
mSt = 13,21 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la masa de una sustancia dada la formalidad