Problema nº 8 de estequiometría de las disoluciones, formalidad - TP09
Enunciado del ejercicio nº 8
¿En cuántos ml de Pb(NO₃)₂ 2 F están contenidos 600 mg de Pb²⁺?
Desarrollo
Datos:
mPb = 600 mg
C = 2 F
Solución
Calculamos el peso fórmula-gramo de nitrato plumboso:
Pb(NO₃)₂: 207,19 g + 2·(14,0067 g + 3·15,9994 g) = 331,1998 g
Una disolución 2 F contiene 2 PFG de nitrato plumboso por litro de disolución y contiene 2 PFG de ion plumboso por litro de disolución, por tanto:
PFGPb = 2·207,19 g
PFGPb = 414,38 g
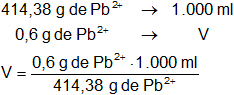
V = 1,447946329 ml
Resultado, el volumen de nitrato plumboso 2 F que contiene 600 mg de Pb²⁺ es:
V = 1,45 ml
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la formalidad de una disolución