Problema nº 2 de estequiometría de las disoluciones, molaridad - TP09
Enunciado del ejercicio nº 2
¿Cuál es la molaridad de una disolución (sc) que contiene 16 g de CH₃OH en 200 ml de disolución?
Desarrollo
Datos:
mCH3OH = 16 g
VSc = 200 ml
Solución
Calculamos la masa de CH₃OH que hay en 1 litro de disolución:

x = 80 g de CH₃OH
Calculamos la masa del mol de metanol:
CH₃OH: 12,01115 g + 15,9994 g + 4·1,00797 g = 32,04243 g
Calculamos la molaridad referida al mol hallado:
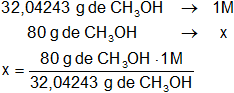
x = 2,496689546 M
Resultado, la molaridad de una disolución (sc) es:
C = 2,5 M
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la molaridad de una disolución