Problema nº 7 de estequiometría de las disoluciones, equivalente-gramo y normalidad - TP09
Enunciado del ejercicio nº 7
Calcular la normalidad de las siguientes disoluciones:
a) 7,88 g de HNO₃ por litro de disolución;
b) 26,5 g Na₂CO₃ por litro de disolución
Solución
a)
Calculamos el peso molecular del ácido nítrico:
HNO₃: 1,00797 g + 14,0067 g + 3·15,9994 g = 63,01287 g
Calculamos el equivalente gramo del ácido nítrico:
![]()
Eg = 63,01287 g
Calculamos la normalidad de disolución dada:
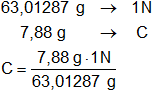
C = 0,125053818 N
Resultado a), la normalidad de la disolución es:
C = 0,125 N
b)
Calculamos el peso molecular del carbonato de sodio:
Na₂CO₃: 2·22,9898 g + 12,01115 g + 3·15,9994 g = 105,98895 g
Calculamos el equivalente gramo del carbonato de sodio:
![]()
Eg = 52,994475 g
Calculamos la normalidad de disolución dada:
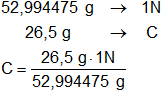
C = 0,500052128 N
Resultado b), la normalidad de la disolución es:
C = 0,5 N
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la normalidad de disoluciones