Problema nº 8 de teoría atómica - TP03
Enunciado del ejercicio nº 8
¿Cuántos moles son 1,2·10²⁵ moléculas de NH₃? ¿Cuál es su masa?
Desarrollo
Datos:
Moléculas de NH₃ = 1,2·10²⁵
1 mol ≡ 6,02·10²³ moléculas
Solución
Calculamos los moles de amoníaco que hay en 1,2·10²⁵ moléculas de este:

n = 19,93 moles de NH₃
Respuesta: los moles que corresponden a 1,2·10²⁵ de moléculas de NH₃ son 19,93
Para conocer la masa de 1,2·10²⁵ moléculas de amoníaco calculamos el mol del amoníaco.
Los pesos atómicos de los elementos presentes en el amoníaco son:
mH = 1,00797 g
mN = 14,0067 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
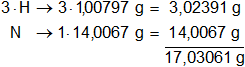
1 mol de NH₃ = 17,03061 g
Luego:
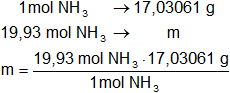
x = 339,480598 g de NH₃
Respuesta: la masa de amoníaco que hay en 1,2·10²⁵ moléculas de NH₃ es 339,480598 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular los moles por moléculas en una sustancia