Problema nº 1 de peso molecular y átomos gramo - TP06
Enunciado del ejercicio nº 1
Calcular:
a) ¿Cuántos átomos gramo de calcio hay en 12 g de calcio?
b) ¿Cuántas moléculas gramo de amoníaco (NH₃) hay en 5,2 g de esta sustancia?
Desarrollo
Datos:
Masa Ca = 12
Masa atómica Ca = 40
Masa atómica N = 14
Masa atómica H = 1
mNH₃ = 5,2 g
Solución
a)
El peso atómico del calcio es 40 g y está compuesto por un átomo.
Calculamos los átomos que hay en 12 g de calcio:
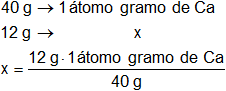
x = 0,3 átomos gramo de Ca
Respuesta a): en 12 g de calcio hay 0,3 átomos gramo de calcio
b)
Calculamos el mol de NH₃, multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
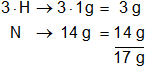
El mol de amoníaco es = 17 g
Calculamos los moles de amoníaco que hay en 5,2 g de este:

n = 0,3 moles o moléculas gramo de NH₃
Respuesta b): en 5,2 g de amoníaco hay 0,3 moléculas gramo de NH₃
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular los moles y átomos gramo en una cantidad de sustancia