Problema nº 6 de composición centesimal y peso atómico - TP07
Enunciado del ejercicio nº 6
Se dispone de dos sustancias gaseosas cuyas composiciones y densidades son:
| Compuesto | % de x | Densidad absoluta (g/dm³) |
|---|---|---|
| M | 50,0 | 2,857 |
| N | 94,1 | 1,51 |
Hallar el peso atómico del elemento x.
Desarrollo
Datos:
V = 22,4 dm³ (volumen molar)
Fórmulas:
![]()
Solución
Se supone CNPT.
El volumen molar de los gases en CNPT es igual para todos y su valor es 22,4 dm³. Aplicamos la fórmula de densidad:
![]()
Despejamos la masa del mol para cada compuesto:
MolM = δ gas M·V
MolN = δ gas N·V
Reemplazamos por los valores y calculamos:
MolM = 2,857 g/dm³·22,4 dm³
MolM = 63,9968 g
MolN = 1,51 g/dm³·22,4 dm³
MolN = 33,824 g
Con estos datos podemos calcular la masa del elemento x presente en cada compuesto.
Para el gas M:
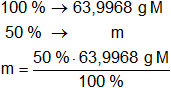
m = 31,9984 g de x en M
Para el gas N:
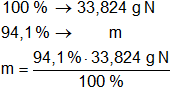
m = 31,828384 g de x en N
En ambos compuestos la masa del elemento x es aproximadamente 32 g.
Respuesta, el peso atómico del elemento x es 32 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplos de cómo calcular el peso atómico de un elemento