Problema nº 3 de composición centesimal e isótopos - TP08
Enunciado del ejercicio nº 3
El argón natural está formado por tres isótopos, cuyos porcentajes son los siguientes: 0,337 % Ar³⁶; 0,063 % Ar³⁸; 99,600 % Ar⁴⁰. Las masas nuclídicas de estos isótopos son: 35,968; 37,963 y 39,962, respectivamente. Calcular el peso atómico del argón a partir de estos datos.
Solución
Armamos la tabla de contingencia:
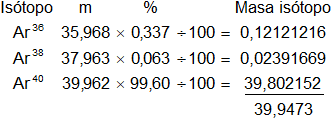
Peso atómico = 39,9473
Respuesta, el peso atómico del argón es: 39,947
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplos de cómo calcular el peso atómico a partir de los isótopos