Problema nº 7 de moles de sustancia - TP08
Enunciado del ejercicio nº 7
Calcular los moles hay en:
a) 24,5 g H₂SO₄;
b) 4,00 g de O₂
Desarrollo
Para hallar el valor de una molécula gramo o mol de una sustancia debemos conocer el valor de los pesos atómicos relativos de los átomos que la forman.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
Solución
a) H₂SO₄
Los pesos atómicos de los elementos presentes en el ácido sulfúrico son:
mH = 1,00797 g
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
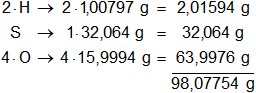
molH₂SO₄ = 98,07754 g
Calculamos los moles de ácido sulfúrico contenidos en 24,5 g de H₂SO₄:

n = 0,24980235 moles
Respuesta a): los moles hay en 24,5 g de H₂SO₄ son:
n = 0,25 moles
b) O₂
Los pesos atómicos de los elementos presentes en el oxígeno son:
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
![]()
molO₂ = 31,9988 g
Calculamos los moles de oxígeno contenidos en 4,00 g de O₂:
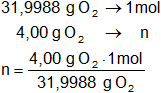
n = 0,125004688 moles
Respuesta b): los moles hay en 4,00 g de O₂ son:
n = 0,125 moles
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplos de cómo calcular los moles en una sustancia