Problema nº 9 de moles de sustancia - TP08
Enunciado del ejercicio nº 9
Calcular los moles que representan:
a) 9,54 g de SO₂;
b) 85,16 g de NH₃
Desarrollo
Para hallar el valor de una molécula gramo o mol de una sustancia debemos conocer el valor de los pesos atómicos relativos de los átomos que la forman.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
Solución
a) SO₂
Los pesos atómicos de los elementos presentes en el dióxido de azufre son:
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
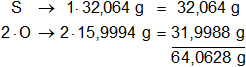
molSO₂ = 64,0628 g
Calculamos los moles de dióxido de azufre contenidos en 9,54 g de SO₂:
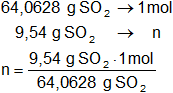
n = 0,148916376 moles
Respuesta a): los moles que hay en 9,54 g de SO₂ son:
n = 0,1489 moles
b) NH₃
Los pesos atómicos de los elementos presentes en el amoníaco son:
mN = 14,0067 g
mH = 1,00797 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
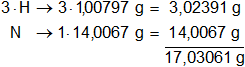
molNH₃ = 17,03061 g
Calculamos los moles de amoníaco contenidos en 85,16 g de NH₃:

n = 5,000408089 moles
Respuesta b): los moles hay en 85,16 g de NH₃ son:
n = 5,0 moles
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplos de cómo calcular los moles en una sustancia