Problema nº 7 de composición centesimal - TP09
Enunciado del ejercicio nº 7
a) Determinar el porcentaje de hierro en cada uno de los compuestos siguientes: FeCO₃; Fe₂O₃; Fe₃O₄.
b) ¿Cuántos gramos de hierro podrían obtenerse de 2.000 gramos de Fe₂O₃?
Desarrollo
mFe = 55,847 g
mC = 12,01115 g
mO = 15,9994 g
Para hallar el valor de una molécula gramo o mol de una sustancia debemos conocer el valor de los pesos atómicos relativos de los átomos que la forman.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
Solución
a)
- FeCO₃
Multiplicamos los pesos atómicos de los elementos presentes en el carbonato ferroso por la cantidad de átomos presentes en la sustancia y sumamos:
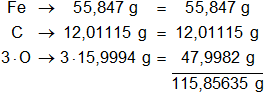
1 mol de carbonato ferroso pesa 115,85635 g, equivale al 100 % de la masa.
Determinamos el porcentaje de la masa de hierro presente en el mol:
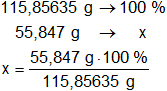
x = 48,2036591 % de Fe
Respuesta: el porcentaje de hierro en el FeCO₃ es: 48,20 %
- Fe₂O₃
Multiplicamos los pesos atómicos de los elementos presentes en el óxido férrico por la cantidad de átomos presentes en la sustancia y sumamos:
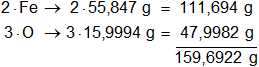
1 mol de óxido férrico pesa 159,6922 g, equivale al 100 % de la masa.
Determinamos el porcentaje de la masa de hierro presente en el mol:
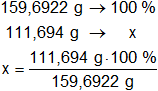
x = 69,94330343 % de Fe
Respuesta: el porcentaje de hierro en el Fe₂O₃ es: 69,94 %
- Fe₃O₄
Multiplicamos los pesos atómicos de los elementos presentes en el óxido ferroso-férrico por la cantidad de átomos presentes en la sustancia y sumamos:
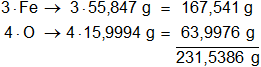
1 mol de óxido ferroso-férrico pesa 159,6922 g, equivale al 100 % de la masa.
Determinamos el porcentaje de la masa de hierro presente en el mol:
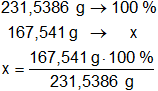
x = 72,35985706 % de Fe
Respuesta: el porcentaje de hierro en el Fe₃O₄ es: 72,36 %
b)
Del ítem anterior sabemos que 1 mol de óxido férrico pesa 159,6922 g y que contiene 111,694 g de Fe.
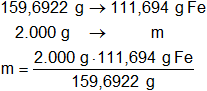
mFe = 1.398,866069 g de Fe
Respuesta, de 2.000 gramos de Fe₂O₃ se obtienen: 1.399 g de Fe
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la composición centesimal en una sustancia