Problema nº 2 de fórmula mínima - TP09
Enunciado del ejercicio nº 2
Un compuesto analizado dio la siguiente composición en porcentaje: K = 26,57 %; Cr = 35,36 %; O = 38,07 %. Deducir la fórmula mínima.
Desarrollo
Datos:
K = 26,57 %
Cr = 35,36 %
O = 38,07 %
Masa atómica K = 39,102
Masa atómica Cr = 51,996
Masa atómica O = 15,9994
Solución
Calculamos el número de átomos gramos de cada componente que hay en 100 % del compuesto:

![]()
![]()
El número de átomos gramos de cada elemento debe ser entero, dividimos por el menor valor:
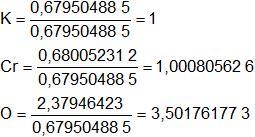
Multiplicamos todos por 2:
K = 2
Cr = 2,001611253 ≅ 2
O = 7,003523547 ≅ 7
Respuesta, la fórmula mínima es: K₂Cr₂O₇
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplos de cómo calcular la fórmula mínima