Problema nº 4 de fórmula mínima en una transformación química - TP09
Enunciado del ejercicio nº 4
Una muestra de uranio de 2,5 gramos se calentó en presencia de aire. El óxido resultante pesaba 2,949 gramos. Determinar la fórmula mínima.
Según la ley de Lavoisier: "en toda transformación química se conserva la clase y la masa de los elementos que en ella intervienen".
Solución
En 2,949 g de muestra hay 2,5 g de uranio, por tanto, la cantidad de oxígeno es:
2,949 g - 2,5 g = 0,449 g de O
Calculamos el porcentaje de cada elemento en la muestra.
Los pesos atómicos de los elementos presentes en la muestra son:
mU = 238,03 g
mO = 15,9994 g
Calculamos el número de átomos gramos de cada componente que hay en la muestra:
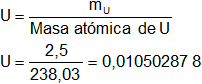
![]()
![]()
El número de átomos gramos de cada elemento debe ser entero, dividimos por el menor valor:
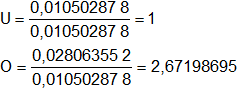
Aún no son números enteros, multiplicamos todos por 3:
U = 1·3 = 3
O = 2,67198695·3 = 8,015960849 ≅ 8
Respuesta, la fórmula mínima es: U₃O₈
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplos de cómo calcular la fórmula mínima