Problema nº 5 de fórmula mínima en una transformación química - TP09
Enunciado del ejercicio nº 5
Una muestra de 1,367 gramos de un compuesto orgánico se quemó en una corriente de aire y dio 3,002 g de CO₂ y 1,640 g de H₂O. Si el compuesto original contenía C, H y O, ¿cuál es su fórmula mínima?
Según la ley de Lavoisier: "en toda transformación química se conserva la clase y la masa de los elementos que en ella intervienen".
Solución
La masa de los productos de racción es:
3,002 g + 1,640 g = 4,642 g
La diferencia con la masa de la muestra es el oxígeno del aire:
4,642 g - 1,367 g = 3,275 g de O₂ del aire
El carbono y el hidrógeno solo provienen del compuesto original, nos enfocamos en ellos.
Calculamos la masa de C e H en los compuestos finales, hallamos los pesos moleculares.
Los pesos atómicos de los elementos presentes en la muestra son:
mC = 12,01115 g
mH = 1,00797 g
mO = 15,9994 g
Multiplicamos los pesos atómicos de los elementos presentes en el dióxido de carbono por la cantidad de átomos presentes en la sustancia y sumamos:
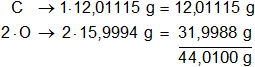
Luego, repetimos con el agua:
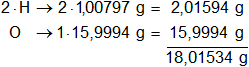
Calculamos el número de átomos gramos de cada elemento por mol que hay en la masa de cada producto de reacción:
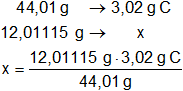
x = 0,819302733 g de C
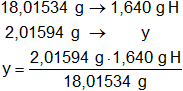
y = 0,183518135 g de H
Hasta aquí tenemos la cantidad de átomos presentes en el componente original.
A la muestra inicial le restamos la masa de carbono e hidrógeno y tendremos la masa de oxígeno presente en ese compuesto:
1,367 g - (x + y) = z g de O
1,367 g - (0,819302733 g + 0,183518135 g) = z g de O
1,367 g - 1,002820868 g = z g de O
z = 0,364179132 g de O
Calculamos el número de átomos gramos de cada componente que hay en la muestra:
![]()
![]()
![]()
![]()
![]()
![]()
El número de átomos gramos de cada elemento debe ser entero, dividimos por el menor valor:
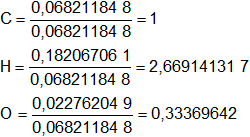
Aún no son números enteros, multiplicamos todos por 3:
C = 1·3 = 3
H = 2,669141317·3 = 8,007423952 ≅ 8
O = 0,33369642·3 = 1,001089261 ≅ 1
Respuesta, la fórmula mínima es: C₃H₈O₁
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplos de cómo calcular la fórmula mínima