Enlaces químicos (segunda parte)
Otros Elementos De Un Enlace
Soluciones
Todas las soluciones están formadas por al menos un soluto y un solvente. Las soluciones son mezclas homogéneas entre solutos y solventes. El soluto es el que se disuelve en el solvente. El solvente debe encontrarse siempre en mayor cantidad, excepto el agua.
Conductibilidad
Ningún solvente puro conduce la corriente eléctrica. Y ningún soluto puro conduce la corriente eléctrica, a menos que este en estado líquido. Pero una solución puede conducir la corriente. Para que esto suceda, la solución debe estar formada por un soluto electrolito (es decir, compuestos formado por enlaces iónicos no orgánicos) y por un solvente polar como el agua, lo cual forma una solución electrolítica.
Las soluciones de NaCl (sal común) o CuSO₄ (sulfato cúprico) en agua conducen la electricidad a toda su intensidad. Pero, el ácido acetico o vinagre común (CH₃—CO—OH) al disolverse en agua produce iones los cuales pueden conducir la electricidad, pero solo levemente.
Resonancia
Una extensión interesante de la estructura de Lewis, llamada resonancia, se encuentra por ejemplo en los iones nitrato, NO₃-. Cada N tiene originalmente cinco electrones de valencia, cada O tiene seis, y uno más por la carga negativa, suman un total de 24 [5 + (3·6) + 1] electrones para cuatro átomos. Esto proporciona un promedio de seis electrones por átomo, por tanto, si se aplica la regla del octeto de Lewis, debe producirse un enlace covalente. Se sabe que el átomo de nitrógeno ocupa una posición central rodeado por los tres átomos de oxígeno, lo que proporcionaría una estructura de Lewis aceptable, excepto porque existen tres estructuras posibles. En realidad, sólo se observa una estructura. Cada estructura de resonancia de Lewis sugiere que debe haber dos enlaces simples y uno doble. Sin embargo, los experimentos han demostrado que los enlaces son idénticos en todos los sentidos, con propiedades intermedias entre las observadas para los enlaces simples y los dobles en otros compuestos. La teoría moderna sugiere que una estructura de electrones compartidos localizados, tipo Lewis, proporcionaría la forma y simetría general de la molécula más un grupo de electrones deslocalizados (representados por puntos) que son compartidos por toda la molécula.
Definiciones
Enlace químico: fuerza entre los átomos que los mantiene unidos en las moléculas. Cuando dos o más átomos se acercan lo suficiente, puede producirse una fuerza de atracción entre los electrones de los átomos individuales y el núcleo de otro u otros átomos. Si esta fuerza es lo suficientemente grande para mantener unidos los átomos, se dice que se ha formado un enlace químico. Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Enlace iónico: concepto de enlace químico. Enlace iónico. Estructuras cristalinas de los compuestos iónicos. Límites de estabilidad. Energía de red. Ciclo de Born-Haber. Propiedades generales de los compuestos iónicos.
Enlace covalente: introducción. Teoría de Lewis. Teoría del enlace de valencia. Carácter dirigido del enlace covalente. Orbitales híbridos. Resonancia. Teoría de repulsión de pares de electrones de la capa de valencia. Teoría de orbitales moleculares. Moléculas diatómicas homo y heteronucleares. Transición entre el enlace iónico y covalente: electronegatividad y polarización.
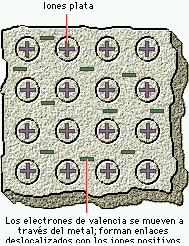
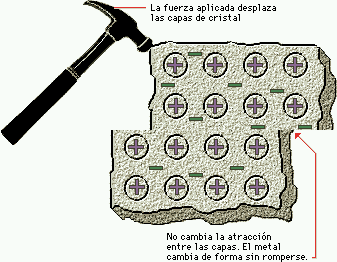
Enlace metálico: propiedades generales de los metales. Estructuras de los metales. Teoría de enlace. Conductores aislantes y semiconductores.
Enlaces intermoleculares: evidencias. Enlaces por fuerzas de van del waals: orientación, inducción y dispersión. Enlaces de hidrógeno. Propiedades de los compuestos covalentes.
Tipos de enlace
En la unión o enlace de los átomos pueden presentarse los siguientes casos:
1) Enlace iónico, si hay atracción electrostática
2) Enlace covalente, si comparten los electrones
3) Enlace covalente coordinado, cuando el par de electrones es aportado solamente por uno de ellos
4) Enlace metálico, son los electrones de valencia pertenece en común a todos los átomos
Conclusiones:
Bueno, como hemos visto al hacer jugo o endulzar al té se producen una serie de reacciones químicas que nunca hubiéramos imaginado. Los enlaces, las soluciones, la fractura de enlaces y la formación de otros, ¿quién lo hubiera imaginado? Pero ahora que sabemos todo esto, cuando nos sentemos a tomarnos un té ya no se nos olvidara pensar en esto.
Bibliografía:
- "Enciclopedia Microsoft ® Encarta ® 2.000"
- Química II Educación Media Editorial Santillana
- Y en las siguientes páginas de Internet:
- http://www.ur.mx/cursos/diya/quimica/jescobed/esteq2.htm
- http://www.ur.mx/cursos/diya/quimica/jescobed/estequio.htm
- http://www.oei.org.co/fpciencia/art08.htm
Autor: Santiago Moscoso y Diego Rodríguez.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›
¿Qué es un enlace químico y cómo se clasifican? ¿Cómo se representa un enlace covalente?